Sotto richiesta insistente di Gabriele, oggi sono qui per raccontarvi del Bramble Cay Melomys, cui nome scientifico è Melomys rubicola (Thomas, 1924), piccolo roditore abitante, o forse sarebbe meglio dire ex-abitante, di Bramble Cay, una piccola isola corallina sita a Torres Strait, Australia.
Da come, spero, avrete capito un po’ dal titolo e un po’ dalla breve introduzione, questa specie è stata purtroppo dichiarata Extinct (EX), secondo la scala IUCN, nel 2016.
Allora perché dedicare un post intero ad un roditore che non esiste più??? Continuate a leggere e capirete il perché…
Prima di tutto un po’ di storia, prometto che sarò breve!
M. rubicola è stato trovato per la prima volta nel non molto lontano 1845, dal Luogotenente Yule, comandante della HMS Bramble, e dalla sua squadra che si trovava proprio sull’isola corallina. Secondo le testimonianze dell’epoca, la popolazione di questa specie stava benone, aveva infatti un’elevata densità e la si trovava spesso. Durante quella missione, un individuo di questa specie venne raccolto da un certo MacGillivray, trasportato sulla HMS Fly, per poi essere descritto. Cosa che però avvenne solo nel 1924.
Qualche decade dopo, per essere precisi nel dicembre 1978, è stato possibile fare una stima della popolazione vivente, e secondo quanto pubblicato poi [1], si contavano alcune centinaia di individui.
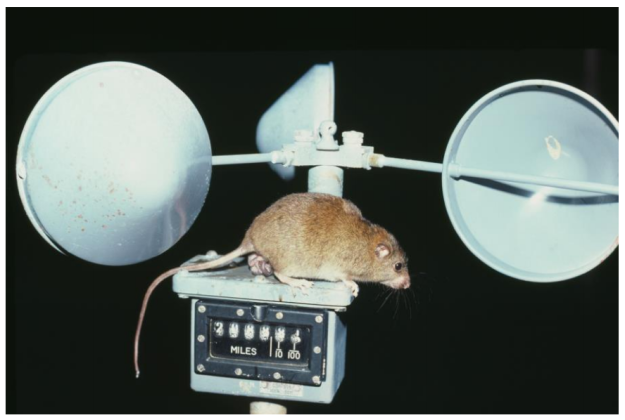
15 anni dopo venne fatto il primo censimento con tanto di trappole notturne ai fini di ottenere una stima scientificamente corretta e coerente. Risultato? La popolazione si era drasticamente ridotta al di sotto del centinaio di individui, dato che si basava sulla cattura di 42 individui.
Dato questo basso numero, i censimenti continuarono per poter monitorare l’andamento della specie, nel 2002 e 2004 vennero fatte due nuove indagini che portarono alla cattura di 10 e 12 individui rispettivamente. Il declino continuava inesorabilmente…
Andiamo verso i nostri giorni. Per essere precisi siamo nell’anno 2011. Nuovo censimento. Nuovi strumenti. Individui trovati: 0.
Gli scienziati non mollano. Anno 2014, mese di Marzo, nuovo sforzo, aumento del numero delle trappole. Individui trovati: 0.
Questo è stato il momento, l’anno, in cui gli scienziati hanno iniziato a preoccuparsi sul serio, disperati sì ma non sono mica rimasti con le mani in mano, nemmeno decisero di dare conclusioni troppo azzardate, questo perché il monitoraggio del Marzo 2014 era stato fatto in modo abbastanza superficiale. Quindi, si rimboccarono le maniche e nella seconda metà del medesimo anno partì una nuova missione, carica di massimo sforzo mentale e fisico, che aveva lo scopo di trovare il topolino, portarlo nell’entroterra, farlo sviluppare e riprodurre in modo da arrivare ad un numero abbastanza elevato e poi riportarlo nell’isola natia. Più di 900 trappole notturne furono utilizzate, a questo si sommarono le fototrappole, osservazioni personali, ricerca di danni ai nidi di tartarughe, ricerca di resti di scheletri o di resti mummificati, qualsiasi cosa che potesse provare anche la minima presenza del Melomys rubicola nell’isola.
Purtroppo, però, nonostante il grande impegno, questo piccolo roditore non è stato ritrovato.
L’ultima presenza documentata è datata 2004, l’ultima testimonianza invece risale al 2009, quando un pescatore sostenne di aver visto il piccolo Melomys ancora presente sull’isola.
In conclusione, nonostante Limpus avesse già avvisato negli anni ’80 che l’unica popolazione conosciuta di Melomys rubicola stesse crollando numericamente, nonostante tutti gli sforzi, la specie è stata dichiarata estinta da Bramble Cay.
Ma com’è possibile che un’intera specie possa scomparire in così poco tempo? E, di nuovo, perché QUESTA specie è così importante, tanto da aver causato molto scalpore durante tutto il 2016 nella comunità scientifica? Tranquilli che ci stiamo arrivando!
Non è possibile dare la colpa ad un solo fattore per quanto riguarda l’estinzione di questa popolazione. Secondo quanto riportato da [2] bisogna andare con un certo ordine:
Cani domestici e la caccia da parte di indigeni che ogni tanto mettono piede su Bramble Cay hanno potuto ridurre il numero già critico della popolazione, MA non così tanto da causarne l’estinzione; l’impatto quindi di questo fattore è estremamente limitato.
Erosione da parte del vento: essendo Bramble Cay un’isola molto piccola, l’attività erosiva è riuscita a modificare notevolmente il perimetro dell’isola e le sue dimensioni, basti pensare che nel 1998 la dimensione totale era di 4 ettari mentre nel 2004 era di soli 2 ettari. PERÓ, è stato altresì osservato che l’attività erosiva abbia un andamento stagionale, quindi fluttua nel tempo, portando ad un continuo effetto collo di bottiglia*.
La disponibilità dei rifugi si è andata riducendo nel tempo, nonostante anche questo fattore mostri un pattern stagionale.
Problema: non è chiaro come l’effetto a collo di bottiglia e la riduzione dei rifugi possa aver causato una scomparsa così rapida della specie. Gli scienziati cercarono quindi altre cause, come ad esempio:
Riduzione drastica della copertura vegetale: dal 2004 al 2014 si è ridotta di ben il 97%!!!! In particolare il Melomys dipendeva per cibo e rifugio da Portulaca oleracea.
Ed ecco che finalmente si arriva ad un fattore che si ipotizza essere chiave nell’estinzione del roditore. Ma davvero una riduzione della vegetazione ha fatto estinguere una specie? Chi ha causato la riduzione in numero delle piante in modo così rapido da portare ad un’equivalente riduzione numerica di un mammifero?
La risposta era sotto al naso degli scienziati: era il cambiamento delle condizioni climatiche globali e locali. In particolare, ed è qui che potremmo dire che venga il bello, è stata l’oscillazione delle inondazioni oceaniche sull’isola ad aver causato la morte di tutti gli organismi.

“Mi stai dicendo che un’ondata di acqua ha fatto affogare un’intera specie? Che cosa c’entrano allora le piante?”
Ve l’ho detto che la cosa si sarebbe fatta interessante andando avanti con la lettura!
Come ormai tutti dovremmo sapere, il livello medio del mare a livello globale sta aumentando, si parla di valore MEDIO, cioè da qualche parte si alza di più e da altre parti meno. Bene, il nord dell’Australia, e di conseguenza Bramble Cay, ha registrato i tassi di crescita del livello del mare più alti [3].
Numerosi articoli [4, 5, 6, 7, 8] hanno dimostrato che le inondazioni oceaniche sono di grande impatto sulle isole coralline e sono conseguenza del cambiamento climatico antropogenico.
Eventi riguardanti almeno una parziale inondazione di Bramble Cay sono stati già documentati in passato in diverse occasioni nell’ultimo quarto di secolo [9, 10, 11], e proprio durante l’ultimo monitoraggio del 2014 sono state osservate inondazioni ed infiltrazioni di acqua nell’isola.
Ora, è complesso dire se l’acqua marina abbia distrutto la vegetazione da cui la specie era totalmente dipendente o se le onde abbiano direttamente ucciso gli individui, o se sia stata la combinazione di entrambe le cose, quello che è certo è che la forza delle onde è stata in grado di distruggere un’intera popolazione di roditori terrestri.
Come avrete capito dagli ultimi paragrafi, le inondazioni casuali sono dovute ad un aumento del livello del mare, che è una delle conseguenze del cambiamento climatico, che è a sua volta un fenomeno causato/accelerato dall’attività antropica. Perché vi sto dicendo questo? Perché è arrivato il momento della tanto attesa risposta alla domanda iniziale “Allora perché dedicare un post intero ad un roditore che non esiste più???”
*Rullo di tamburi*
L’estirpazione del Melomys rubicola da Bramble Cay è avvenuta per un aumento del livello del mare. L’incidenza così elevata di eventi climatici estremi, come appunto sono state le inondazioni, avvenuti in pochi anni è stato così significativo da andare a provocare e a rappresentare la prima estinzione documentata di mammifero dovuta solamente (o primariamente) al Cambiamento Climatico di origine antropica.
Il cambiamento climatico è reale e le conseguenze le stiamo già osservando.
Francesca
Note
Sono in atto monitoraggi in zone limitrofe a Bramble Cay per avere la certezza assoluta che la specie non si trovi più da alcuna parte, gli scienziati ovviamente tutt’oggi sperano di trovare almeno delle specie ad essa affini.
Il testo esposto è una versione riadattata, redatta e riassuntiva del report pubblicato da Gynther et al. (2016) [2], dal quale sono tratte anche le due fotografie che corredano l’articolo.
* In biologia delle popolazioni, con ‘collo di bottiglia’ si intende una situazione nella quale solo pochi individui di una popolazione sopravvivono ad un evento distruttivo casuale.
Bibliografia
[1] Limpus, C.J., Parmenter, C.J. & Watts, C.H.S. 1983. Melomys rubicola, an endangered murid rodent endemic to the Great Barrier Reef of Queensland. Australian Mammalogy 6: 77–79.
[2] Gynther, I., Waller, N. & Leung, L.K.-P. 2016. Confirmation of the extinction of the Bramble Cay melomys Melomys rubicola on Bramble Cay, Torres Strait: results and conclusions from a comprehensive survey in August–September 2014. Unpublished report to the Department of Environment and Heritage Protection, Queensland Government, Brisbane.
[3] Church, J.A., Woodworth, P.L., Aarup, T. & Wilson, W.S. (eds.) 2010. Understanding Sea-Level Rise and Variability. Wiley-Blackwell, Hoboken, NJ, USA.
[4] Mimura, N. 1999. Vulnerability of island countries in the South Pacific to sea level rise and climate change. Climate Research 12: 137–143.
[5] Church, J.A., White, N.J. & Hunter, J.R. 2006. Sea-level rise at tropical Pacific and Indian Ocean islands. Global and Planetary Change 53: 155–168.
[6] Mimura, N., Nurse, L., McLean, R.F., Agard, J., Briguglio, L., Lefale, P., Payet, R. and Sem, G. 2007. Small islands. In Climate Change 2007: Impacts, Adaptation and Vulnerability. Contribution of Working Group II to the Fourth Assessment Report of the Intergovernmental Panel on 40 Climate Change (Eds M.L. Parry, O.F. Canziani, J.P. Palutikof, P.J. van der Linden & C.E. Hanson), pp 687–716. Cambridge Press, Cambridge, UK.
[7] Department of Climate Change. 2009. Climate Change Risks to Australia’s Coasts. A First Pass National Assessment. Australian Government, Canberra, ACT.
[8] Webb, A.P. & Kench, P.S. 2010. The dynamic response of reef islands to sea-level rise: Evidence from multi-decadal analysis of island change in the Central Pacific. Global and Planetary Change.
[9] Dennis, A. & Storch, D. 1998. Conservation and Taxonomic Status of the Bramble Cay Melomys, Melomys rubicola. Unpublished Report to Environment Australia Endangered Species Program Project No. 598. Queensland Department of Environment, Atherton, Qld.
[10] Latch, P. 2008. Recovery Plan for the Bramble Cay Melomys Melomys rubicola. Environmental Protection Agency, Brisbane, Qld.
[11] Gynther, I., Fell, D.G. & Freeman, A. 2014a. Results of a March 2014 Survey of Bramble Cay and Three Other Uninhabited Islands in the North-eastern Torres Strait, with Particular Reference to the Bramble Cay Melomys. Unpublished report to the Department of Environment and Heritage Protection, Queensland Government, Brisbane.